Idealna metoda ekstrakcji powinna spełniać następujące warunki:
1. wyekstrachowany materiał nie powinien mieć zmienionych właściwości
2. wyizolowana substancja próchniczna powinna być wolna od zanieczyszczeń
3. wydzielony materiał powinien zawierać wszystkie frakcje związków próchnicznych
4. metoda powinna być uniwersalna dla wszystkich gleb
| Środek ekstrahujący | % wyekstrahowanej substancji organicznej | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| NaOH | | "Łagodne" ekstraktanty: | Na4P2O7 i sole kwasów organicznych | Organiczne związki chelatujące | Kwas mrówkowy HCOOH | | ||||
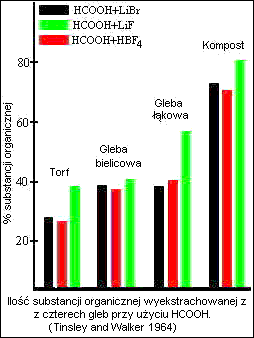
Ilość substancji organicznej wyizolowanej z gleby przez alkalia wzrasta wraz z czasem trwania ekstrakcji. Otrzymywanie preparatów kwasów fulwowych (FA)
1. Kolumnę (namoczoną wcześniej przez 24 godz. w alkoholu metylowym) napełnić żywicą Otrzymywanie preparatów kwasów huminowych
Ekstrakcja alkaliczna
Niepożądane cechy tej metody to:"Łagodne" środki ekstrahujące
Na4P2O7 i inne sole
Kwas mrówkowy- HCOOH
Organiczne związki chelatujące
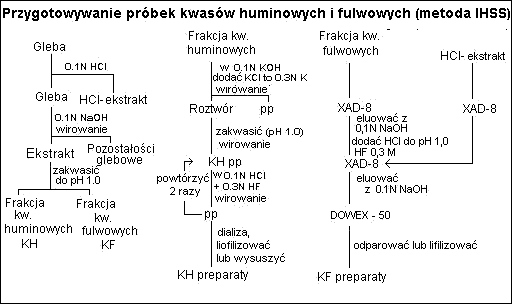
Odczynniki te są raczej nieskuteczne w przypadku innych typów gleb. (Stevenson 1982)Ekstrakcja związków próchnicznych zmodyfikowaną metodą HSS
3. przepłukać 100 cm3 0.1 M HCl,
4. przemyć 100 cm3 wody destylowanej,
5. przepłukać 100 cm3 0.1 M NaOH,
6. przemyć 100 cm3 wody destylowanej.
7. Do kolumny wprowadzić 100 cm3 ekstraktu glebowego z HCl (FF) i przefiltrować.
8. Filtrat zebrać do kolby miarowej na 200 cm3, kolumnę przemyć 100 cm3 0,01 M H2SO4
15. Kolumnę przepłukać 100 cm3 0,01 N H2SO4, przesącz odrzucić.
16. Pozostałe na kolumnie frakcje kwasów fulwowych (FA) eluować 100 cm3 0,1 M NaOH.
17. Eluat zakwasić HCl do pH 1 oraz dodać HF do uzyskania 0,3 M roztworu i odwirować.
18. Supernatant przepuścić przez kolumnę XAD-8.
19. Kolumnę przemyć 100 cm3 0,01 N H2SO4.
20. FA pozostałe na XAD-8 eluować za pomocą 100 cm3 0,1 M NaOH.
21. Eluat FA-Na przepuścić przez kolumnę DOWEX-50 wysyconą jonami H.
22. Kolumnę przemyć 100 cm3 wody destylowanej i połączyć z roztworem FA po przejściu