Zalety stosowania metod spektroskopowych związane są z faktem, iż:
- nie wykazują one działania destrukcyjnego,
- do badań potrzebne są niewielkie naważki próbek,
- są one proste w wykonaniu.
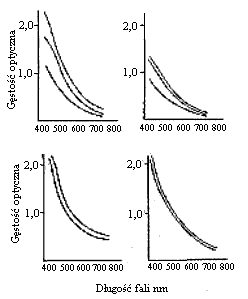
Badanie właściwości optycznych w zakresie światła widzialnego i ultrafioletowego
Spektroskopia w podczerwieni (IR)
- określa rodzaj, reaktywność i budowę grup funkcyjnych,
- wykazuje obecność węglowodanów i protein,
- wykazuje obecność lub brak mineralnych zanieczyszczeń,
- technika ta jest odpowiednia dla analizy ilościowej.
- pasma absorpcji w strefie 3300 cm-1 odpowiadają drganiom grup -OH;
- pasma w zakresie 2900 cm-1 są charakterystyczne dla drgań rozciągających wiązań C-H;
- w zakresie liczby falowej 1720 cm-1 stwierdza się obecność wiązania C=O w grupach karboksylowych i rozciągającego wiązania C=O grup karbonylowych ketonów;
- adsorpcja w zakresie 1610 cm-1 świadczy o wiązaniach C=C w połączeniach aromatycznych oraz w wiązaniach C=O;
- w zakresie liczby falowej 1460 cm-1 stwierdza się obecność drgań zginających wiązania C-H występującego w grupie metylowej;
- w zakresie 1390 cm-1 stwierdza się obecność drgań rozciągających grupy C=O lub drgań zginających wiązania O-H;
- pasma absorpcji w strefie 1250 cm-1 odpowiadają drganiom rozciągającym C-O fenoli lub deformacyjnym -OH grupy karboksylowej.
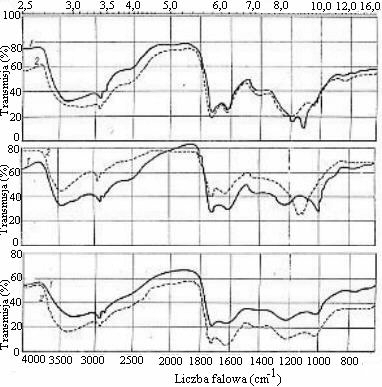
Stevenson i Goh wyróżnili następujące typy spektrogramów IR związków próchnicznych:
Typ 1 - spektrogramy charakterystyczne dla kwasów huminowuch. Występuje silne pasmo absorpcji w strefach 3400, 2900, 1720, 1600 i 1200 cm-1.Typ 2 - spektrogramy charakterystyczne dla kwasów fulwowych, odznaczające się silną absorpcją w strefie 1720 cm-1.
Typ 3 - spektrogramy podobne do typów 1 i 2, ale występują w nich dodatkowo silniejsze absorpcje w zakresie 1540 cm-1 i 2900 cm-1. Jest to typowe dla protein i węglowodanów.
Paramagnetyczny rezonans elektronowy (ESR)
Pod względem zawartości wolnych rodników, substancje próchniczne można uszeregować następująco: kwasy fulwowe > kwasy huminowe > huminy (Riffaldi i Schnitzer 1972).
- kwasy huminowe wykazują widma w zakresie 1,75 do 1,90 gauss,
- spektrogramy ESR, w zależności od pH gleby, można podzielić na dwie grupy. Kwasy ze środowiska kwaśnego (pH 2,8 - 4,3) wykazują czteroliniowe widma na spektrogramach, natomiast ze środowiska mniej kwaśnego (pH 4,3 - 7,2) wykazują słabo wykształcone widma, bez wyraźnych pików,
- nie stwierdzono wpływu głębokości miejsca pobrania próbek lub wieku gleby na widma ESR, na ich wykształcenie (wyrazistość pików) wpływa jednak roślinność porastająca glebę.